소개
2017년 5월 25일부터 지침 90/385/EEC 또는 93/42/EEC를 준수하여 인증 기관에서 발행되었고, 2021년 5월 26일에도 유효한 철회되지 않은 인증서의 유효 기간을 연장합니다.
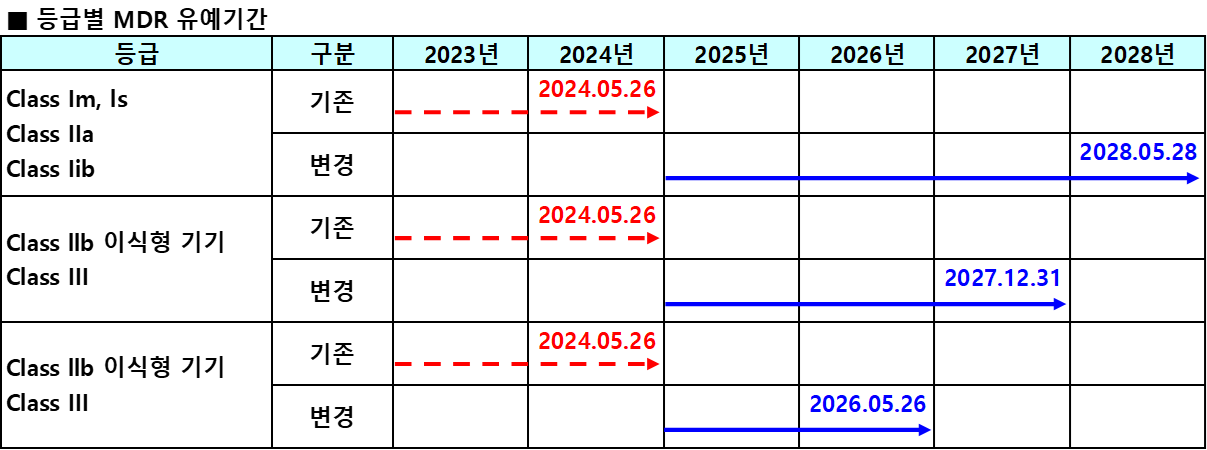
연장 이유
유럽 MDR 유예 기간의 연장은 다음과 같은 몇 가지 이유로 시행되었습니다:
복잡성 및 규모: MDR 구현에는 상당한 변화와 복잡성이 수반되므로 제조업체가 규정 준수를 보장하는 데 추가 시간이 필요합니다.
코로나19 범유행: 대유행은 자원, 우선순위 지정 및 공급망의 중단 측면에서 어려움을 제기하여 유예 기간을 연장할 필요가 있습니다.
통지된 본문의 제한된 가용성: MDR 인증을 위한 지정 통보 기관의 수가 제한되어 인증 절차가 지연되어 연장의 필요성이 제기되고 있습니다.
확장 내용
연장된 유예 기간은 다음과 같은 주요 요소를 포함합니다:
비준수 장치의 지속적인 사용: 제조업체는 특정 조건에 따라 MDR 구현 기한 전에 이미 시장에 출시된 의료 장치를 계속 사용할 수 있습니다.
적합성 평가를 위한 추가 시간: 이 확장은 제조업체가 필요한 적합성 평가를 완료하고 MDR의 요구 사항을 충족할 수 있는 더 많은 시간을 제공합니다.
경과 규정: 특정 장치에 대한 면제 및 단순화된 절차를 포함하여 이전 의료 장치 지침(MDD)에서 MDR로의 전환을 촉진하기 위한 구체적인 규정이 마련되어 있습니다.
규제 당국과의 협업: 제조업체는 연장된 유예 기간 동안 지침을 찾고, 요구 사항을 명확히 하며, 규정 준수를 보장하기 위해 규제 당국과 개방적인 커뮤니케이션을 유지하도록 권장됩니다. 제조업체는 확장의 세부 사항을 주의 깊게 검토하고 제품에 적용되는 구체적인 요구 사항과 일정을 이해하는 것이 중요합니다. MDR 준수는 여전히 중요하며, 제조업체는 연장 기간을 현명하게 사용하여 원활한 전환과 지속적인 시장 접근을 보장해야 합니다.
참고: 유럽 MDR 유예 기간 연장과 관련하여 정확하고 최신 정보를 얻으려면 최신 공식 자료 및 규제 지침을 참조하는 것이 필수적입니다.
'의료기기' 카테고리의 다른 글
| MDR Basic UDI-DI 이해 (0) | 2023.05.31 |
|---|---|
| MDR 규정 준수 책임자(PRRC) 책임 및 관리문서 (0) | 2023.05.31 |
| MDR GSPR Checklist 작성 방법 (0) | 2023.05.31 |
| MDR_일반 안전 및 성능 요구 사항(GSPR)_요구사항 이해 (0) | 2023.05.31 |
| MDR_MDCG의료 기기 규정을 위한 리소스 (0) | 2023.05.30 |



